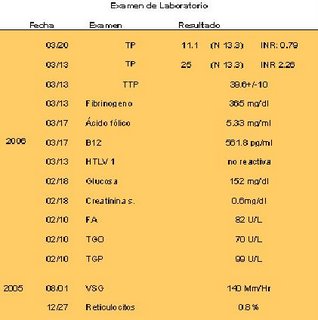
El STA Compact® y la línea STA® de reactivos codificados por códigos de barras, desarrollados como un Sistema Integral para asegurar resultados fiables. Con su sistema de Detección Basado en la Viscosidad, el STA Com
 pact® ofrece una elevada sensibilidad para todos los tests de coagulación y total eficiencia para todos los tipos de plasma.
pact® ofrece una elevada sensibilidad para todos los tests de coagulación y total eficiencia para todos los tipos de plasma.El STA Compact® realiza simultáneamente ensayos de coagulación, cromogénicos e inmunológicos de acceso aleatorio. Ofrece operaciones flexibles: carga contínua de muestras, producción de estadísticas en tiempo rápido, nueva ejecución y adición de tests en cualquier momento. Configuración de tests fácilmente programables por el usuario.
BENEFICIOS
-Resultados rápidos. PT, PTT y Fibrinógeno en menos de 7 minutos.
-Hasta 120 resultados por hora.
-Capacidad walk-away para 1000 cubetas, 45 posiciones de enfriado para reactivos y 96 posiciones para muestras en carga.
-Más de 30 reactivos codificados.
-Capacidad de realizar cualquier prueba especializada.
SIMPLE, PERO INTELIGENTE:
-Flujo de trabajo optimizado. Carga de muestras y reactivos en
 cualquier momento y posición. -Reconoce automáticamente donde ha sido colocada la muestra y el reactivo. Un LED próximo a la muestra indica cuando ha terminado el análisis y se puede sacar el tubo del sistema.
cualquier momento y posición. -Reconoce automáticamente donde ha sido colocada la muestra y el reactivo. Un LED próximo a la muestra indica cuando ha terminado el análisis y se puede sacar el tubo del sistema.-Todos los datos de calibradores y controles son registrados por códigos de barras, rápidos y seguros.
-Control de calidad automático con un intervalo de control definido por el usuario.
DESCRIPCION DEL SISTEMA
· 96 posiciones de muestra
· Identificación positiva de las muestras mediante código de barras
· Carga aleatoria
· Perforado de tapones*
· Válido para todos los tamaños de tubos, incluyendo pediátricos y micro contenedore
 s.
s.SOFTWARE INTEGRADO
Flexibilidad para reiniciar o añadir test en cualquier momento
Consulta en host e interface bidireccional
Programa de control de calidad integrado
Mantenimiento mediante software
Hasta 80 tests programables
MANEJO DE LOS REACTIVOS.
45 posiciones para reactivos refrigeradas a +15° C

Identificación positiva de reactivos mediante código de barras
Carga aleatoria
Capacidad multivial para un mismo reactivo
SISTEMA DE MEDIDA y DETECCION
Ensayos simultáneos de coagulación, cromogénicos e inmunológicos
Sistema de detección basado en la viscosidad para tests de coagulación
3 agujas para muestreo con Detección del nivel de líquido
Diluciones y rediluciones automáticas

CONSUMIBLES
Bobina de 1000 cubetas unitarias
Identificación mediante código de barras
Manejo de consumibles mediante software
LINEA DEDICADA A REACTIVOS.
Reactivos de rutina y especializados precalibrados mediante código de barras (PT, Fibrinógeno, D-Dímero y PS libre)
Manejo completo de los reactivos (nombre, número de lote,
 volumen, estabilidad y fecha de caducidad)
volumen, estabilidad y fecha de caducidad)Amplio meANALISADOR AUTOMÁTICO XXL-STA COMPACT
METODOLOGIA INSTRUMENTAL :
I) INGRESO DE REACTIVO
1. Abrir el cajón numero 2
2. Ingresar los reactivos por código de barra.
¤ REACTIVOS UTILIZADOS:
■ TP (Neoplastine plus): Evalúa la vía extrínseca (VII) y la vía común (X, V, II, I).
■ TTP: evalúa la vía Intrínseca (XII; XI; IX; VIII) y la vía común (X; V; II; I).
■ Fibrinógeno.
■ Factor VIII y otros factores.
■ Anticoagulante lúpico.
II) INGRESO DE LA MUESTRA
1. Abrir el cajón 1.
2. Introducir el ID de la muestra, seleccionar el análisis que pide.
3. Confirmar.
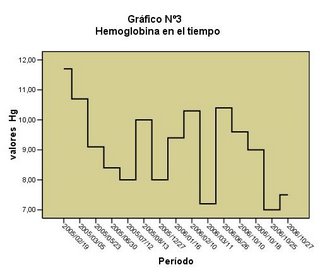
CONTROL DE CALIDAD
Debe realizarse:
1. Antes de empezar el funcionamiento.
2. Al menos 12 horas durante el funcionamiento.
3. Después de operaciones de mantenimiento.
4. Siempre que exista cualquier duda sobre la exactitud de los valores de análisis.
I) MATERIAL DE CONTROL
Control:
- Plasma Nivel normal
- Plasma Nivel patológico
II) MÉTODOS DE CONTROL
- Control Levy – Jennings
III) CALIBRACIÓN
- Se realiza cada véz que se cambia de kit de reactivos
- Cuando los controles no estan dentro del rango adecuado.
.+Photo+Author.jpg)